Исследователи из совместной лаборатории Сколтеха и Университета Шарджи и их коллеги из Университета Париж-Сакле узнали, уровни каких биомолекул в нервной ткани меняются при недостаточном поступлении кислорода в мозг младенца при родах. Полученные сведения помогут лучше понять природу возникающих в этом случае поражений мозга и искать лекарства для снижения тяжести последствий — часто ущерб тканям оказывается необратимым и влечёт тяжёлые неврологические нарушения. Авторы также представили ценную модель для биомедицинских исследований мозга. Работа опубликована в журнале Fluids and Barriers of the CNS при поддержке РНФ.
Падение артериального давления матери или другие факторы могут ограничивать поступление крови в мозг младенца во время родов или до них. В результате орган получает недостаточно кислорода (родовая асфиксия), что может нанести ущерб мозгу (энцефалопатия) — в зависимости от страны такое случается от одного случая на 666 новорождённых вплоть до одного случая на 38 новорождённых. В числе возможных последствий детский церебральный паралич и другие нарушения нервно-психического развития, которые требуют пожизненного ухода. Пока единственным вариантом терапии гипоксической ишемической энцефалопатии остаётся гипотермия: пребывание младенца первые три дня жизни в среде с пониженной температурой уменьшает ущерб мозгу и снижает шансы возникновения инвалидности.
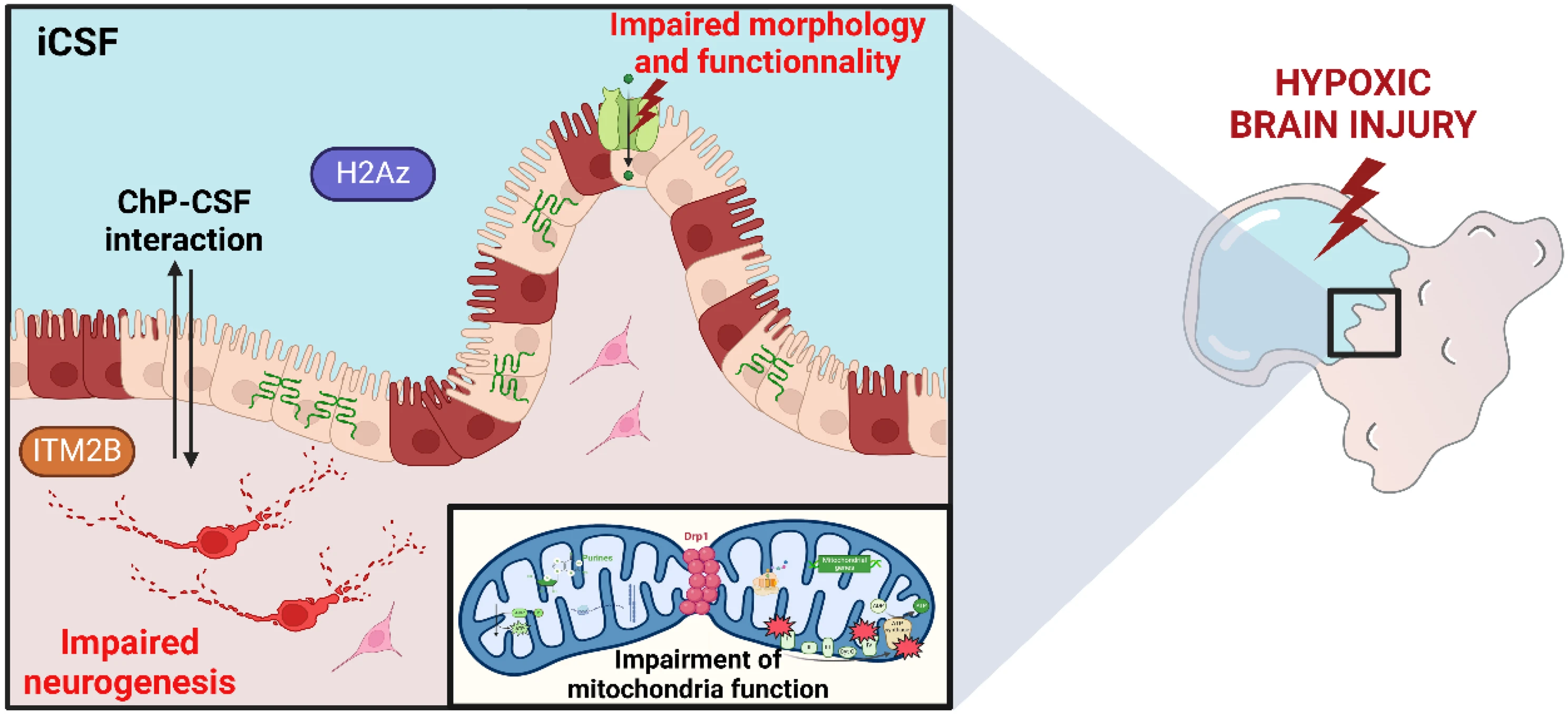
Один из авторов исследования, старший преподаватель Максим Шараев — соруководитель совместной Лаборатории искусственного интеллекта для биомедицины (BIMAI-Lab) со стороны Сколтеха — пояснил смысл работы: «Цель в том, чтобы найти молекулу лекарства, которое бы можно было назначить новорождённому при диагностировании энцефалопатии, чтобы воздействовать на конкретные нежелательные последствия и минимизировать ущерб. Чтобы достичь этой цели, мы должны понимать, что происходит в поражённом мозге: как недостаток кислорода влияет на уровни белков в мозге и какие молекулярные процессы нарушаются. А для этого надо понимать, уровни каких биомолекул повышаются или понижаются при гипоксии по сравнению с нормой».
Для решения вышеуказанных вопросов необходим подходящий эксперимент. Результаты экспериментов на мышах не могут быть в полной мере перенесены на людей, а тесты на клетках мозга человека не учитывают сложность мозга как органа, который имеет структуру и состоит из клеток разных подтипов.
Как научный коллектив вышел из положения, объяснил один из авторов исследования, профессор Рифат Хамуди — соруководитель совместной Лаборатории искусственного интеллекта для биомедицины (BIMAI-Lab) со стороны Университета Шарджи: «В работе использованы мозговые органоиды. Это модели разных частей мозга, выращенные из индуцированных плюрипотентных стволовых клеток, которые получаются путём перепрограммирования обыкновенных зрелых клеток разных тканей. Часть органоидов поместили в среду с дефицитом кислорода, а часть — в обычные условия. Далее было проведено экспериментальное исследование для определения механизмов влияния гипоксии на биохимию мозга».